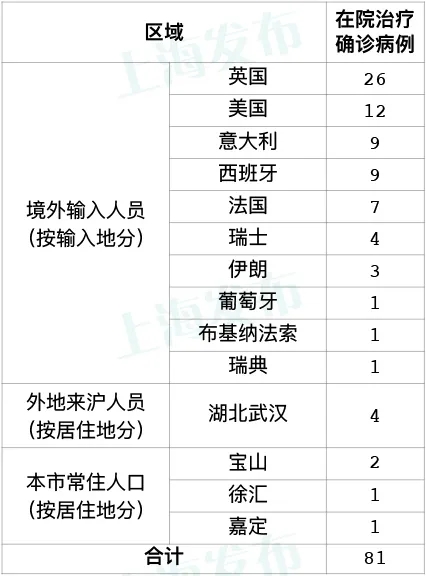
据上海市卫生健康委员会网站消息,上海市卫生健康委员会组织专家研究制定的《上海市菌群移植技术管理规范(2021年版)》正式发布。
各区卫生健康委,申康医院发展中心、有关大学、中福会,市卫生健康委监督所,各市级医疗机构,市医学会,市医疗质量控制管理事务中心:
为规范菌群移植技术的临床应用,保证医疗质量和安全,根据上海市医疗技术临床应用管理办法实施细则,我委组织专家研究制定了《上海市菌群移植技术管理规范(2021年版)》,现印发给你们,请遵照执行。
特此通知。
上海市卫生健康委员会
2021年8月27日
上海市菌群移植技术管理规范
(2021年版)
菌群移植术(fecal microbiota transplantation,以下简称FMT)是将健康人粪便中的功能菌群移植到患者肠道内,重建新的肠道菌群,实现肠道及肠道外疾病的治疗。为规范FMT的临床应用,保证医疗质量和医疗安全,制定本规范。本规范是医疗机构及其医务人员开展FMT的最低要求。
本规范适用于应用同种异基因FMT治疗消化系统及肠道菌群紊乱所致的消化系统外疾病,其粪便来源包括亲属及非亲属。
一、医疗机构基本要求
(一)医疗机构开展FMT治疗应当与其功能、任务和技术能力相适应,有合法的粪菌捐献来源。
(二)有卫生健康行政部门核准登记的消化内科、普通外科、重症医学科、心理科、感染科、影像科、内镜中心、检验科、临床营养科、微生物实验室及相关专业诊疗科目。
(三)有合法的伦理审查机构。
(四)独立开展FMT治疗技术的科室应具备的条件
1.有FMT专用病房,床位5张以上,配备低温储存设施、菌液加热与保温装置。
2.有二级生物安全防护实验室及相关实验设备,能够保证菌液的制作、存储与转运,实验室配备实验室主任1名,菌液和胶囊制备专业技术人员,随访人员。
3.具备检测肠道菌群与代谢、艰难梭状芽孢杆菌(CDI)、耐药菌、新冠病毒核酸检测和人类单基因遗传测序的相关科室。
4.具有独立的粪便供体库或稳定的供体来源。
5.成人科室开展儿童FMT治疗的,还应当至少有1名具有副主任医师及以上专业技术职务任职资格的本医疗机构儿科医师。
(五)其他相关科室
1.开展FMT治疗的,应当具有质量控制和质量评价措施的实验室或有固定协作关系的实验室,能够进行供体的生化检测、传染病病原体检测,供体粪便及微生态制品的致病病原体检测、多重耐药菌检测、细菌培养、活细胞计数和细菌菌株鉴定。FMT治疗所需的相关检验项目参加市级及以上卫生健康行政部门指定的室间质量评价机构的室间质量评价并合格。
2.有消化系统及肠道菌群紊乱所致的消化系统外疾病相关诊断、检验和检查科室。
3.通过内镜或置管行FMT,需有内镜中心或介入放射科,能够建立FMT途径。
二、人员基本要求
(一)取得《医师执业证书》,执业范围为内科、外科或儿科专业的本医疗机构在职医师,经过GCP培训并取得证书。
(二)有5年以上消化科、儿科和神经精神领域临床诊疗工作经验、参与FMT工作1年以上,有FMT适应证的判断能力及合并症的诊断和处理能力。FMT治疗工作负责人还应当具有高级职称并有研究生学历、参与FMT工作3年以上。
(三)在市卫生健康行政部门指定的培训基地经过FMT治疗相关系统培训,具备开展FMT临床应用的能力。
(四)独立开展FMT治疗技术的科室,应配备5名及以上经过FMT治疗培训合格的执业医师。
(五)按照护士与床位比1.7∶1配备护士。护理人员和医技人员应经过FMT治疗相关系统培训,满足开展FMT治疗临床应用所需的相关条件。
(六)开展FMT临床研究的,应配备临床研究负责人及档案管理人员。临床研究负责人需取得《医师执业证书》,通过GCP培训并取得证书,具有从事FMT治疗相关的临床研究工作经验1年以上;档案管理人员需经过FMT相关临床研究系统培训。
三、技术管理基本要求
(一)严格遵守FMT治疗操作规范和诊疗指南,严格掌握FMT治疗适应证和禁忌证。
1.FMT适用于治疗以下消化系统疾病
(1)艰难梭状芽胞杆菌感染:复发性/难治性艰难梭状芽胞杆菌感染。
(2)其他消化系统疾病:溃疡性结肠炎、克罗恩病、功能性便秘、肠易激综合征、菌群紊乱相关腹泻等。
2.应用FMT治疗治疗肠道菌群紊乱所致的消化系统外疾病
(1)神经系统疾病:帕金森病、阿尔兹海默症、癫痫等。
(2)精神系统:自闭症、情绪障碍、多动症、抽动症等。
(3)代谢相关疾病:代谢综合征、糖尿病等。
(4)肿瘤相关疾病:免疫治疗及放化疗所致肠炎等。
(二)除复发性/难治性艰难梭状芽胞杆菌感染外,出于其他治疗目的使用FMT治疗均须以临床研究形式开展,并通过本机构伦理审查与备案。
(三)实施FMT治疗前应当向患者及其家属告知治疗目的、风险、注意事项及可能发生的并发症等,并签署知情同意书。
(四)医疗机构应当建立完整的电子化临床数据库及严格的术后随访制度,在完成每例FMT治疗后应当按照有关规定将治疗相关信息上报卫生健康行政部门。
(五)技术要求
1.受体要求
(1)有明确与肠道菌群紊乱有关的肠道内疾病,如肠功能障碍性疾病、肠道感染性疾病(复发性CDI)、肠道炎症性疾病及假性和麻痹性肠梗阻等;(2)有明确与肠道疾病或者肠道菌群紊乱有关的肠道外疾病,如便秘合并帕金森病、便秘或腹泻合并自闭症、便秘或腹泻合并过敏性皮炎;(3)患者需充分理解FMT治疗过程及机制,并签署知情同意书。
如出现以下情况之一则不应行FMT治疗:(1)肠道大面积溃疡、出血;(2)移植通道梗阻;(3)移植操作本身(内镜、置管、灌肠、经口饮食)的禁忌证;(4)未通过伦理审核的临床试验或患者拒绝接受FMT。
如出现以下情况不宜行FMT治疗:(1)生命体征(体温、心率、血压、呼吸)不稳定;(2)严重免疫系统紊乱;(3)孕妇或哺乳期妇女;(4)代偿或者失代偿肝功能障碍。
2.供体筛选
(1)生理:主要依赖科学测量与实验室检测完成。①年龄18-30周岁,体重指数(body mass index,BMI)18.5-23.9 kg/m2,儿童医院开展FMT,供体要求可放宽至15-30周岁;②血液学检测:血常规、肝肾功能、电解质、C反应蛋白正常,肝炎病毒、HIV、梅毒、EB病毒、巨细胞病毒、COVID-19抗体、线虫、阿米巴等病原检测阴性;③粪便检测:粪便常规检查正常,隐血实验阴性,艰难梭菌、弯曲菌、沙门菌、志贺菌、产志贺毒素大肠杆菌及虫卵、囊泡、寄生虫、阪崎肠细菌、小肠结肠耶尔森菌、致病性弧菌(副溶血弧菌、霍乱弧菌)、气单胞菌、阿米巴、孢子、诺如病毒、轮状病毒和新型冠状病毒(COVID-19)等病原学检测阴性,多重耐药基因(超广谱β内酰胺酶、碳青霉烯酶和耐药万古霉素等)检测阴性,粪便幽门螺旋杆菌抗原阴性。
(2)心理:主要依赖访谈与量表完成。①心理科医师或心理咨询师访谈认定心理状态良好;②抑郁自评量表(self-rating depression scale,SDS)、焦虑自评量表(self-rating anxiety scale,SAS)、匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)等评分正常。
(3)个人情况:主要依赖访谈与问卷完成。①既往史:近2周未出现胃肠道不适,近3个月内未使用抗生素、抑酸剂、免疫抑制剂、化疗药、输血史等,无慢性疼痛症状,无消化系统手术史,无传染病史及传染病接触史,无过敏性疾病、自身免疫疾病、代谢性疾病、心脑血管疾病、神经系统或精神疾病史,无恶性肿瘤病史,未接受过生长激素、胰岛素、凝血因子等静脉注射;②个人史:作息规律,饮食健康,家庭和睦,无不良性交,无吸烟、饮酒、吸毒等嗜好,无药物成瘾,近6个月未接种过疫苗或参加药物试验,近6个月未接受纹身或出现皮肤破损,近6个月无热带地区旅居史;③家族史:无胃肠道病变家族史,无恶性肿瘤家族史,无传染病家族史;④其他:非孕期,非经期。
(4)稳定性:依赖生化检查及粪便微生物组测序和代谢组学完成。①每2个月复查以上条目,仍然符合上述要求;②每次捐赠的粪便均留样行宏基因或者16s rDNA测序(根据各自单位检测能力),保证菌群组成及多样性稳定;③每次捐献粪便应留样行代谢组学检测。
(5)持续性:建立档案与随访系统。供体应保证长期(≥6个月)捐赠粪便,至少每周2次,每次不少于100g。
(6)限食耐受性:通过限食实验完成。部分受体存在食物过敏及食物不耐受(如鸡蛋、牛奶等),根据受体要求,供体需在捐赠粪便前5天限制食物种类,如该供体不可耐受,则不可作为本次移植的捐赠者。
(7)遗传学:通过基因谱检测完成。应剔除单基因遗传性疾病(尤其注意隐性遗传)致病基因阳性的供体。
3.菌液制作SOP流程
(1)粪便采集:应采用无菌容器采集,粪便重量不少于100g,性状为Bristol评分标准中3-5分方为合格,立即进入菌液制作流程,或立即密封后2-8℃保存。
(2)制作流程:每次需取不少于50g粪便与无菌生理盐水以1∶3比例混合,充分搅拌混匀后过滤,从粪便排出体外至菌液制作完成应保证在2小时以内,整个处理过程应在无菌环境下操作。为了避免感染窗口期的问题,菌液或胶囊制备后应待21 天后经过病毒细菌等检验合格后出库,每批产品留样至少6个月以供追溯。
(3)冻存与复融:菌液制备完成后置于-80℃保存,6个月之内使用不影响疗效;如置于-20℃保存,应在1-4周内使用。使用前置于室温复融,6小时内输注;如使用水浴锅复融,则水温不得超过37℃。
(4)质控标准:每次制作完成的菌液应随机抽样,行致病菌监测、细胞计数及宏基因或16s rDNA菌群测序,菌液中艰难梭菌、弯曲菌、沙门菌、志贺菌、产志贺毒素大肠杆菌及虫卵、囊泡、寄生虫、孢子、诺如病毒、轮状病毒和COVID-19等病原学检测阴性,多重耐药基因(超广谱β内酰胺酶、碳青霉烯酶等)检测阴性,每50mL菌液中活细胞数应不小于2.5×1012个,同供体同批次样本应达到菌群组成一致,6个月内同供体不同批次样本应达到菌群组成差异无统计学意义。制作完成的菌液应有独立包装与标签。如制作胶囊,还应取胶囊内容物进行细菌活性监测与活细胞计数,其中细菌活性应不低于85%,每克内容物包含活菌数不小于109CFU。
4.FMT操作要求
(1)菌液输注前需结合患者自身情况及疾病种类行肠道准备。
(2)应根据指南及操作规范选择上消化道或下消化道进行菌液输注。
(3)操作时应观察患者耐受情况,并及时处理不良反应。
5.建立不良事件上报制度
(1)管理原则:医疗安全(不良)事件的管理,遵循预防为主、紧急处理、合理控制、防微杜渐、持续改进的原则。
(2)上报要求:凡科室职工均有权上报医疗安全(不良)事件,可通过网络、书面、电话上报,上报时限要求在不良事件发生后24小时之内。
(3)审核、处置要求:科室负责人24小时内审核、处置科室发生的不良事件,并呈报至相关职能部门。主管职能部门自接报之日起,24小时内审核、处置不良事件;对于接报的Ⅱ级及以上不良事件,应呈报至主管院领导。主管院领导对于接报的Ⅱ级及以上不良事件,必要时组织委员会进行讨论分析,并提交院务会。
6.FMT治疗后观察与随访制度
(1)每次菌液输注后密切观察患者耐受情况24小时,如有不良反应立刻处理并及时上报。
(2)1个疗程治疗结束后4周内应对患者症状学和肠道菌群改善情况进行评估,FMT治疗疾病的随访及疗效判断指标主要遵循原发疾病的治疗指南。移植前后重复检测粪便及血液中传染病相关指标,有条件者可行免疫相关检测。
如第1个疗程结束3周后病情无改善,可尝试更换供体,重新给予1个疗程FMT,若有效可继续治疗,若仍无效则应视为FMT无反应性,此时不应继续给予FMT,以免耽误病情;如患者接受FMT治疗后症状明显改善,可重复3-5次FMT后结束治疗。
随访至末次FMT结束后至少8周,有条件者应进行大于1年甚至5年以上的长期随访。
(六)实验室要求
1.制作菌液的实验室至少为二级生物安全防护实验室,具有生物危害标志。
2.实验室总面积应大于30m2,分为粪便采集区、清洗灭菌区、菌液制作区、冷冻保存区4个区域,各区域之间通过传递窗传递物品。
(1)粪便采集区:面积至少为3m2,主要设施为粪便采集马桶。
(2)清洗灭菌区:面积至少为10m2,主要设施包括清洗水池、消毒浸泡池、高压蒸汽灭菌锅、紫外灭菌柜、洗眼器。
(3)菌液制作区:面积至少为10m2,主要设施包括二级生物安全柜、纯水仪、台式离心机、粪便分析前处理仪、洗眼器,如制作胶囊还需有冻干系统。
(4)冷冻保存区:面积至少为7m2,主要设施包括4℃、-20℃、-80℃冰箱或冷柜。
3.消毒隔离要求
(1)实验室实施两级隔离:一级隔离通过生物安全柜、负压隔离器、正压防护服、手套、眼罩等实现;二级隔离通过实验室的建筑、空调净化和电气控制系统来实现。实验室入口处需配备有缓冲间及风淋系统,操作人员进入前需穿隔离衣,佩戴帽子、口罩、手套,操作时需佩戴眼罩。
(2)紫外线消毒:应进行日常监测、紫外灯管照射强度监测和生物监测。日常监测包括灯管应用时间、累计照射时间和使用人签名。对新的和使用中的紫外灯管内进行照射强度监测,新灯管的照射强度不得低于100 μW/cm2,使用中灯管不得低于70 μW/cm2,照射强度监测应每半年进行一次,生物监测在必要时进行,经消毒后的物品或空气中的自然菌应减少90.00%以上,人工染菌杀灭率应达到99.90%。
(3)使用中的消毒剂、灭菌剂:应进行生物和化学监测。生物监测:消毒剂每季度监测1次,其细菌含量必须<100cfu/mL,不得检出致病性微生物;灭菌剂每月监测1次,不得检出任何微生物。化学监测:应根据消毒、灭菌剂的性能定期监测,如含氯消毒剂、过氧乙酸等,应每日监测,对戊二醛的监测应每周不少于1次。应同时对消毒、灭菌物品进行消毒、灭菌效果监测,消毒物品不得检出致病性微生物,灭菌物品不得检出任何微生物。
(4)压力蒸汽灭菌:必须进行工艺监测、化学监测和生物监测。工艺监测应每锅进行,并详细记录。化学监测应每包进行,手术包尚需进行中心部位的化学监测。预真空压力蒸汽灭菌器每天灭菌前进行B-D试验。生物监测应每月进行,新灭菌器使用前必须先进行生物监测,合格后才能使用;对拟采用的新包装容器、摆放方式、排气方式及特殊灭菌工艺,也必须先进行生物监测,合格后才能采用。
(5)实验室地面、台面、各种消毒后物品应每季度进行监测,不得检出致病微生物。
4.实验室人员要求
(1)实验室应配备至少2名技师,负责人应为具有中级及以上职称的技师或医师。
(2)建立工作人员生物安全上岗考核制度和培训档案。实验室负责人应通过市卫生健康行政部门组织的生物安全培训,并考核合格。所有与实验活动相关的人员都应经过生物安全培训并经考核合格后方可上岗,取得上岗资格的人员每年应接受培训。培训对象应包括实验室管理人员、操作人员、样本运输人员、消毒工作人员、废弃物处置人员、仪器设备维修人员、外来进修人员等实验室全体工作人员。培训内容应包括实验室生物安全的基本知识、基本技能和应急处置预案、生物危险和实验室感染预防、菌(毒)种或样本管理、废弃物处置、消毒隔离与职业个人防护等。
(3)应每年对实验人员开展与其从事实验活动相关的健康体检并建立人员健康档案,必要时进行免疫接种。实验室工作人员应在身体状况良好的情况下进入操作区工作,若出现疾病、过度疲劳或其他意外状况,不宜进入操作区。
(七)其他管理要求
1.FMT治疗相关器械、耗材等应符合国家相关法律法规要求,不得重复使用与FMT治疗相关的一次性医用器材。
2.供体粪便来源合法,供体应签署知情同意书并在供体库中注册。
3.建立供体-菌液-受体登记制度,保证菌液来源可追溯、质检信息可查询、菌液去向可追踪。不得通过FMT治疗谋取不正当利益,不得泄露供体及受体个人资料。
4.符合《中华人民共和国人类遗传资源管理条例》。
5.符合中华人民共和国传染病法以及突发传染病疫情的临时管理规定。
四、培训管理要求
(一)拟开展FMT治疗的医师培训要求
1.应当具有《医师执业证书》,具有初级及以上专业技术职务任职资格,经过GCP培训并取得证书。
2.接受至少4个月的系统培训。在指导医师指导下,参与20例以上FMT患者的全过程管理,包括适应证选择、供者筛选、制定方案、并发症处理、移植后管理和随访等,经考核合格,取得资格证书。
3.在境外接受FMT治疗培训4个月以上,有境外培训机构的培训证明,并经省级卫生健康行政部门指定的培训基地考核合格后,可以视为达到规定的培训要求。
4.本规范印发之日前,从事临床工作满15年,具有副主任医师专业技术职务任职资格,近3年独立开展FMT治疗临床应用不少于50例,未发生二级及以上责任程度为包括主要责任的及与FMT相关医疗事故,可免于培训。
(二)培训基地要求
1.培训基地条件
市卫生健康行政部门指定FMT治疗培训基地。培训基地应当具备以下条件。
(1)三级甲等医院,符合FMT治疗管理规范要求。
(2)FMT专用病房,床位数不少于10张。
(3)近3年累计完成FMT治疗不少于300例,每年完成FMT治疗不少于100例。
(4)有至少4名具有FMT能力的指导医师,其中至少1名为副主任医师,研究生学历。
(5)有与开展FMT治疗培训工作相适应的人员、技术、设备和设施等条件。
(6)近3年举办过全国性的与FMT治疗相关的专业学术会议或者承担过FMT治疗国家级继续医学教育项目。
2.培训工作基本要求
(1)培训教材和培训大纲满足培训要求,课程设置包括理论学习、临床实践。
(2)保证接受培训的医师在规定时间内完成规定的培训。
(3)培训结束后,对接受培训的医师进行考试、考核,并出具是否合格的结论。
(4)为每位接受培训的医师建立培训及考试、考核档案。
执行主编/尹学兵
值班编辑/七 七